En esta nota de aplicación, se utilizó el sistema MicroCal VP-Capillary DSC para analizar rápidamente las soluciones amortiguadoras en el desarrollo de preformulaciones y para la optimización de las condiciones de almacenamiento de anticuerpos durante el desarrollo del proceso. Los resultados corresponden con los obtenidos mediante otros métodos de mayor duración.
El uso de productos bioterapéuticos, como los anticuerpos y otras moléculas de proteínas, para combatir enfermedades es un campo en rápido crecimiento en la industria farmacéutica. Por lo general, los productos bioterapéuticos se requieren en altas concentraciones y múltiples dosis, por lo que los fabricantes deben producirlos por kilos o deben producir más medicamentos con base proteica. El proceso de fabricación de productos bioterapéuticos involucra la expresión proteínica en miles de litros de medios bioreactores, seguida por un proceso de purificación que utiliza columnas de cromatografía a gran escala y sistemas de filtración.
La estabilidad de la proteína para procesar las condiciones, la reversibilidad de los cambios conformacionales y cualquier propensión a la formación de agregados depende de factores como el pH y la composición de la solución amortiguadora. Es importante que exista una total comprensión de estos factores para la selección de condiciones de proceso, la formulación y el desarrollo de métodos de análisis. Las medidas en el proceso de purificación del anticuerpo que pueden volver inestable a una proteína incluyen la medida de elusión de pH bajo de la columna de la proteína A, medida de mantención del pH bajo para la inactivación viral y cualquier etapa que involucre el ajuste del pH o de la fuerza iónica, incluida la formulación final.
La calorimetría diferencial de barrido (DSC) proporciona información sobre la estabilidad térmica de una proteína bajo diferentes condiciones de pH y de cosolución, mediante el control de los puntos medios de transición térmica, Tm. Un mayor Tm refleja una mayor estabilidad térmica, que se correlaciona bien con la estabilidad a largo plazo. Esta nota de aplicación describe cómo la biotecnología Diosynth utiliza datos de estabilidad térmica obtenidos de la DSC para caracterizar la estabilidad de un anticuerpo durante las pruebas iniciales de pH y soluciones amortiguadoras para el desarrollo de preformulaciones y la optimización de la inactivación viral de pH bajo utilizados en el proceso de fabricación. La inactivación viral de bajo pH es conveniente para la fabricación de proteínas, siempre que no reduzca la estabilidad de la proteína.
La DSC se realizó utilizando un sistema Malvern MicroCal VP-Capillary DSC. En el estudio de desarrollo de preformulaciones se utilizó un rango de soluciones amortiguadoras con un pH entre 3 y 8. La proteína (anticuerpo X) se almacenó en cada solución amortiguadora y se realizaron ensayos de inmediato (t=0), y después de una semana de almacenamiento (t=1 semana).
Para la optimización de las condiciones de purificación, se estudiaron y compararon termogramas de DSC del anticuerpo Y (en una solución de amortiguación de Tris que contiene NaCl y EDTA, pH 7,4) con una solución de amortiguación de citrato de pH 3 y además, se ajustó la solución de amortiguación de citrato a pH 6 con 2 M Tris. pH 9,0.
Se sustrajeron termogramas de la solución amortiguadora separada de cada proteína antes del análisis con el software Origin™ 7.0 equipado con el software de análisis MicroCal VP-Capillary DSC.
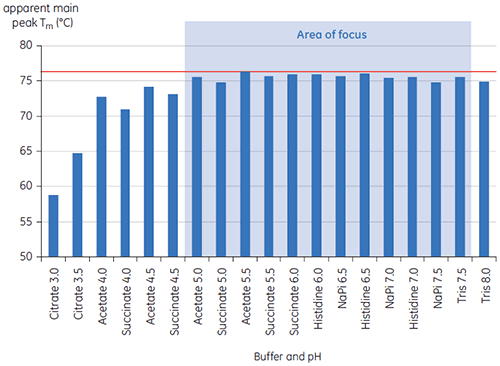
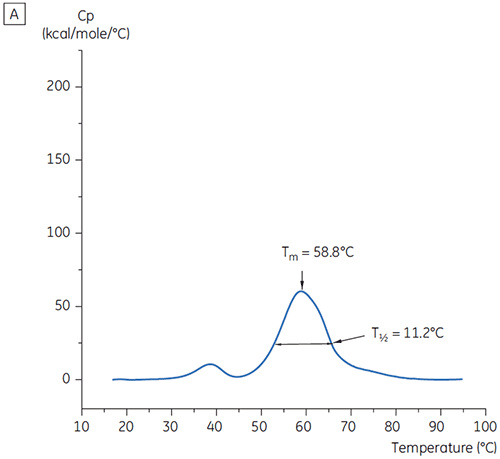
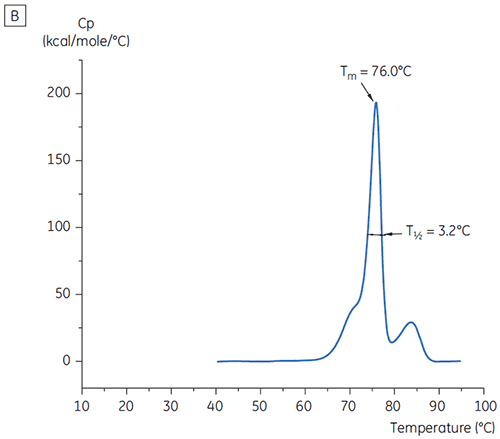
En la Figura 1 se muestran los valores del pico principal de Tm a t = 0 para el anticuerpo X en el estudio inicial de 19 soluciones amortiguadoras para el desarrollo de preformulaciones. En la Figura 2 se muestran los termogramas de DSC para el anticuerpo en dos de estas soluciones de amortiguación. De los valores de Tm, las condiciones de solución amortiguadora más estables se encuentran entre el pH 5,0 y pH 7,5. A t=0, otros métodos de análisis (UV, cromatografía de exclusión de tamaño [SEC], dispersión de luz y SDS-PAGE) se observó mucha menos discriminación entre las condiciones de solución amortiguadora en comparación con la DSC (los datos no se muestran aquí).
|
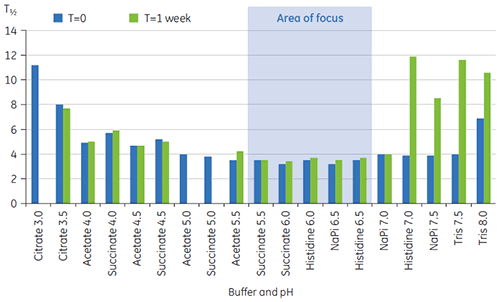
Los valores de T½ se utilizaron para discriminar aún más entre las condiciones, como se indica en la Figura 2. T½ es el ancho del pico a la mitad de altura máxima para la mayor transición en el termograma de DSC y generalmente refleja la cooperatividad de la transición térmica. Un menor valor de T½ puede indicar una estructura más compacta y, por lo tanto, se prefiere para formulaciones. Aquí, los valores más bajos de T½ se encontraron en soluciones amortiguadoras con valores de pH entre 5,5 y 6,5 (Figura 3).
|
|
|
La solución amortiguadora de citrato a pH 3 es un candidato para su uso tanto en la elusión del anticuerpo desde la columna de afinidad de la proteína A y para la posterior medida de mantención de pH bajo para la inactivación viral. Ya que la mayoría de las proteínas tienden a volverse inestables bajo la exposición prolongada a dicho pH bajo, el pH se debe elevar inmediatamente después de la medida de inactivación viral.
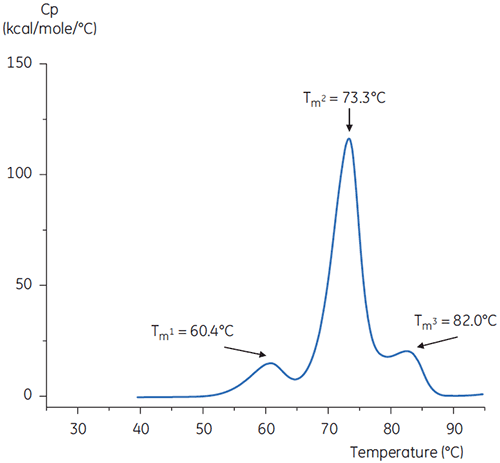
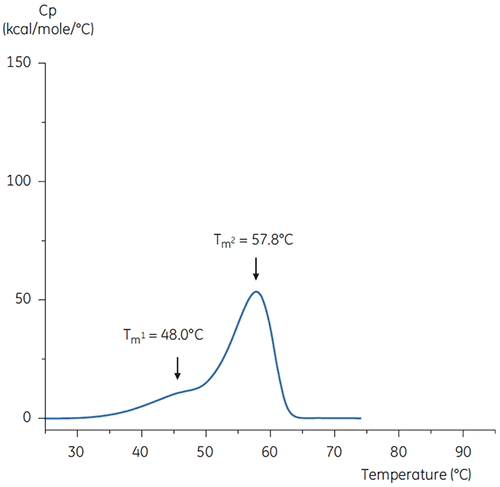
En las Figuras 4 y 5, se muestran los barridos de DSC del anticuerpo en la solución amortiguadora a pH neutro y pH 3.
|
|
Las diferencias de forma y patrones de los dos termogramas indican una pérdida de estabilidad térmica del anticuerpo en la solución amortiguadora de pH 3,0. La altura del pico de la transición del Tm2 es menor, el pico es más ancho y la definición entre la primera y la segunda transición en el pH 3,0 es menos pronunciada en comparación con el pH 7,4.
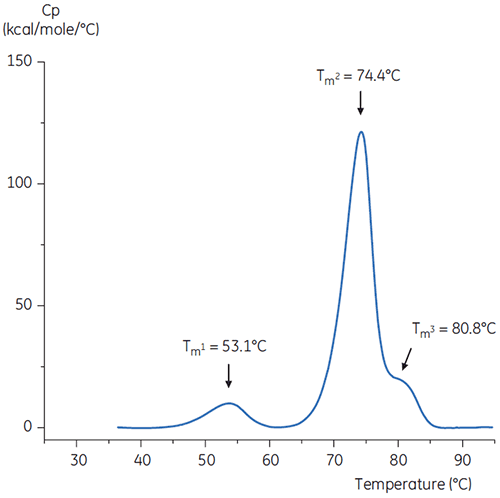
Para imitar la medida de neutralización del pH, el pH de la solución del anticuerpo se ajustó a pH 6,0 con una solución de Tris concentrada a pH 9. En la Figura 6 se indica el termograma de la solución del anticuerpo resultante. Aquí, se observa una estabilidad térmica elevada al anticuerpo en la solución amortiguadora pH 3,0. El Tm2 y Tm3 del anticuerpo en la solución con pH 6,0 son similares al Tm2 y al Tm3 del anticuerpo en la solución amortiguadora de referencia. La forma general, la definición del pico y el ancho del pico para los anticuerpos con Ph 6 también son similares a la situación de referencia con pH 7,4.
La neutralización también se puede realizar en la presencia de excipientes estabilizadores, como la histidina. En este caso, el termograma del anticuerpo neutralizado en presencia de la histidina es casi idéntico al que se muestra en la Figura 6, lo que indica que para este anticuerpo, la histidina no aporta ningún efecto estabilizador significativo.
|
En este estudio se demostró que la DSC se podría usar para optimizar rápidamente las condiciones de pH y de soluciones amortiguadoras para el desarrollo de preformulaciones. Estos datos se usaron para calificar las soluciones amortiguadoras adecuadas y el intervalo de pH apropiado para las pruebas posteriores con excipientes, lo que redujo considerablemente el número de condiciones exploratorias.
El DSC también se puede utilizar para verificar la estabilidad de un anticuerpo durante la medida de mantención de la inactivación de pH bajo y para el seguimiento del ajuste de pH desde 3,0 a 6,0. Este tipo de información de estabilidad es útil para el diseño y la optimización de los procesos para la fabricación de productos biofarmacéuticos.
Esta información fue amablemente proporcionada por la Dr. Kathrine E. Bowers, FUJIFILM Diosynth Biotechnologies USA Inc.