Dans cette note d'application, l'ITC et la DSC ont été utilisées pour caractériser la liaison protéine-excipient, l'une des nombreuses interactions possibles dans une formulation de solution de protéine complexe.
Biopharmaceutical Technologies, GlaxoSmithKline R&D, 709 Swedeland Rd,
King of Prussia, PA 19406 (USA)
Le développement de thérapeutiques reposant sur des protéines est une tâche complexe du fait de l'instabilité inhérente de ces dernières, qui peut se manifester par une instabilité physique (dénaturation, agrégation, adsorption) et par une dégradation chimique (oxydation, désamidation, clivage). Cette instabilité peut conduire à une réduction de l'activité de la protéine ou même à la formation d'espèces potentiellement immunogènes. Une approche de la stabilisation des protéines consiste à modifier les propriétés du solvant dans lequel elles se trouvent, ce qui peut passer par un choix bien réfléchi du système tampon, un ajustement du pH, et l'ajout d'excipients/additifs (c.-a-d. une formulation optimale).
Un facteur important de la stabilisation des médicaments par une action sur le solvant repose sur le choix des excipients ; un autre point tout aussi important est l'optimisation des concentrations de ces excipients, qui assurent une longue durée de conservation tout en assurant le degré de sécurité le plus élevé pour le patient. Ainsi, un élément critique du développement d'une formulation médicamenteuse à base de protéine concerne le choix d'excipients de solubilité appropriée et non toxiques, qui préservent l'intégrité structurale de la protéine, qui confèrent au produit une durée de conservation acceptable, et en préservent l'activité biologique. Ces excipients peuvent être des acides aminés, des sels, des métaux, des tensioactifs, des sucres et des polyols, ainsi que des polymères. Ils peuvent servir de stabilisateurs, d'agents tensioactifs, d'agents antimicrobiens ou antioxydants. Leur effet stabilisateur est généralement spécifique de la protéine et fonction de la concentration.
En plus du choix de l'excipient, il est nécessaire de réunir des informations non seulement sur la concentration optimale de l'excipient, mais également sur les interactions entre les différents composants de la formulation. L'optimisation de la sélection et de la concentration de chaque excipient peut mobiliser du personnel et impliquer un criblage très ouvert des différentes formulations ainsi que des études de stabilité. Bien que des principes généraux relatifs à la stabilisation aient émergé de la littérature au cours des dix dernières années (1), les mécanismes permettant aux excipients d'améliorer la stabilité d'une protéine au stockage sont encore mal compris. Une connaissance des mécanismes d'interaction entre les excipients et les protéines pourrait éviter une approche par criblage purement empirique, et permettrait une conception et une optimisation rationnelles de la formulation de protéines, en réduisant par conséquent le temps et les matériels nécessaires au développement d'un produit à base de protéine. De plus, des informations sur la force et le type des interactions protéine-excipient aideraient à prédire le comportement du médicament in vivo.
Certaines techniques analytiques biophysiques se sont montrées extrêmement utiles pour le criblage d'excipients lors du développement de formulations. En particulier, la calorimétrie est l'une des méthodes les plus efficaces pour évaluer la stabilité et les interactions d'une protéine, car elle permet une caractérisation thermodynamique complète du système, sous réserve que tous les événements soient réversibles. Les études calorimétriques ayant pour but d'explorer les interactions protéine-excipient sont de plus en plus appliquées à la conception et à l'optimisation de formulations biopharmaceutiques. La calorimétrie repose sur la détermination des paramètres énergétiques et stœchiométriques des interactions macromoléculaires, à travers la mesure des échanges de chaleur résultant des processus d'association, de dissociation et/ou de dénaturation. L'ITC est en premier lieu utilisé pour déterminer les paramètres thermodynamiques d'une liaison, tels que l'affinité de liaison et les constantes de dissociation, ainsi que la stœchiométrie, l'enthalpie, l'entropie, et l'énergie libre de Gibbs d'une liaison dans des conditions isothermes. Il peut également être utilisé pour déterminer les variations de capacité calorifique qui accompagnent la formation de la liaison en effectuant des expériences sur une plage de températures. Les données de DSC permettent de mesurer les paramètres thermodynamiques associés à la dénaturation d'une protéine, en particulier le point médian de demi-dénaturation, les variations d'enthalpie, d'entropie, d'énergie libre de Gibbs, et de capacité calorifique associées à la dénaturation.
Ces paramètres thermodynamiques sont couramment utilisés pour comparer la stabilité des protéines dans différentes formulations, ou pour déterminer l'effet stabilisateur ou déstabilisateur de tel ou tel excipient.
Cette note d'application présente un exemple pour lequel la calorimétrie a été utilisée pour faciliter le développement d'une formulation de ProX, en explorant les interactions entre excipient et protéine. Le polysorbate-80 et le phénol ont été étudiés comme additifs potentiels du tampon de la formulation du ProX, et leur comportement a été étudié. Le polysorbate-80 est un tensioactif couramment utilisé pour éviter l'adsorption non-spécifique et l'agrégation des protéines, mais il a été montré qu'il peut interagir avec certaines protéines (2, 3). Il protège la protéine contre l'agrégation induite par la surface en se liant aux régions hydrophobes exposées de la surface de la molécule (3). Les taux de polysorbate-80 les plus couramment utilisés vont de 0,002 à 0,1 % (p/v). Le phénol est utilisé comme agent antimicrobien pour les formulations destinées à être utilisées en plusieurs doses prélevées dans un même récipient. Le phénol est toxique et sa concentration dans le tampon doit par conséquent être minimisée. Les taux les plus couramment utilisés vont de 0,3 à 0,5 % (v/v).
Les expériences ont été réalisées avec un MicroCalTM VP-Capillary DSC. Quatre cent (400) µl de chaque échantillon et du tampon correspondant ont été placés dans une plaque à 96 puits. Les échantillons ont été analysés de 25 à 100 °C, avec une rampe de 60 °C par heure et une période d'équilibrage de 15 minutes avant chaque analyse. Les données ont été analysées à l'aide du logiciel Origin version 7 pour la DSC, après soustraction du tampon et correction de la concentration.
Les expériences ont été réalisées sur un MicroCal iTC200. La cellule d'échantillon était remplie avec 250 µl de ProX à 10 ou 25 mg/ml, et la seringue de titrant était remplie de 40 µl de phénol à 60 mM ou de polysorbate-80 à 50 mM dans le même tampon que le ProX. La cellule de référence était remplie d'eau déionisée. Pour chaque expérience, 40 µl de titrant étaient injectés dans la cellule d'échantillon, par aliquots de 0,2 à 2 µl, à raison de 0,5 µl par seconde. Les paramètres suivants ont été utilisés : vitesse d'agitation 1000 tr/min, puissance de référence 5 à 8 μCal par seconde, mode de rétroaction/gain réglé sur haut, température 25 °C, délai initial 60 secondes. Les analyses témoin du tampon dans le tampon, de la dilution du titrant, et de la dilution du ProX ont été soustraites de chaque expérience. Les données ont été analysées à l'aide d'Origin version 7 pour ITC. Avant analyse par ITC, les échantillons ont été filtrés sur filtres seringues de 0,2 µm à faible affinité pour les protéines (Pall Life Sciences), et chaque échantillon de protéine a été dialysé sur le même tampon que celui utilisé pour préparer la solution d'excipient afin de s'assurer que le tampon est le même dans la seringue et dans la cellule.
La liaison directe des excipients avec le principe actif d'un produit pharmaceutique peut affecter le produit de différentes façons. Des études récentes ont montré que les excipients couramment utilisés dans les formulations pharmaceutiques peuvent affecter la pharmacocinétique des principes actifs (4, 5). Les excipients peuvent également altérer la structure du médicament ou sa biodisponibilité, ce qui en modifie l'efficacité. En plus d'une éventuelle dégradation de la pharmacocinétique ou de l'efficacité du principe actif, les interactions excipient/protéine peuvent également affecter la durée de conservation du médicament. Par conséquent, les interactions entre la protéine et les excipients de la formulation doivent être identifiées et comprises. Si une interaction directe (c.-à-d. une liaison mesurable) est détectée entre la protéine et les excipients de la solution, deux points importants doivent être pris en compte lors de la conception de la formulation d'un médicament ; le premier, la force et/ou la réversibilité de la liaison entre l'excipient et la protéine, qui peut encombrer, voire masquer totalement un site actif critique à la surface de la protéine après l'administration clinique, et le second, la concentration de l'excipient non lié, qui doit être suffisante pour que la solution présente les propriétés désirées. Chacun de ces aspects est illustré ci-dessous pour le ProX.
La figure 1 montre les résultats d'une expérience d'ITC dans laquelle 50 mM de polysorbate-80 ont été injectés dans du ProX à 25 mg/ml. Les données brutes sont présentées dans le panneau (A), et les chaleurs intégrées par injection, après soustraction des témoins, dont présentées dans le panneau (B). Les données du panneau (B) montrent qu'il existe effectivement une interaction mesurable entre le polysorbate-80 et le ProX. Les données ont ajustées sur un modèle à un site avec les paramètres suivants : affinité de liaison (KA) = 1430 ± 260 M-1, enthalpie de liaison (ΔH) = -6,3 ± 1,1 kcal/mol, et nombre de sites de liaison (n) par molécule de ProX égal à 2,6 ± 0,3. La variation d'entropie de liaison (ΔS) a été calculée à -6,7 ± 3,7 cal/mol-K.
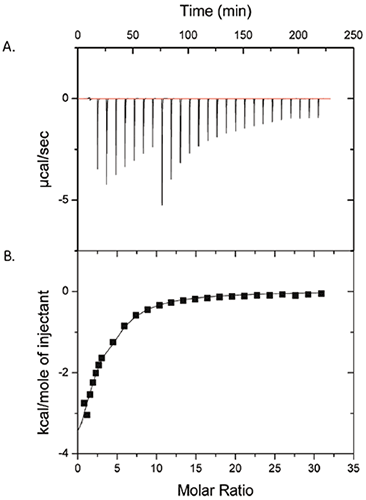
|
Sur la base de l'isotherme (fig 1), il a été conclu que les sites de liaison du polysorbate-80 sur le ProX étaient saturés pour un rapport molaire du polysorbate-80 par molécule de ProX d'approximativement 10. La concentration micellaire critique (cmc) du polysorbate-80 est de 0,012 mM dans l'eau pure et il a été rapportée qu'elle peut atteindre 0,1 mM dans des solutions de protéine (2). La concentration du polysorbate-80 lors de l'expérience d'ITC de la figure 1 allait de 0,1 à 7 mM, au-delà de la cmc dès la première injection. Cette information est importante, car toute interaction détectable pourrait être attribuée à une liaison de la protéine avec les micelles de tensioactif et non pas avec le monomère.
Lors du développement d'une formulation, la connaissance des paramètres de liaison est utile pour déterminer la plus basse concentration possible de l'excipient lié nécessaire pour « saturer » la protéine et atteindre l'effet stabilisateur. La minimisation de la concentration de l'excipient dans une formulation réduit les coûts ainsi que la quantité d'additifs qui sera administrée au patient. Dans cette étude de cas, un excès molaire de 10 fois du polysorbate-80 par molécule de protéine a été suffisant pour saturer la protéine. Les paramètres de liaison peuvent également être utilisés pour prédire le comportement in vivo du complexe protéine-excipient ; ainsi, les constantes de dissociation faibles mesurées par ITC suggèrent que le complexe ProX/polysorbate-80 se dissociera par dilution à son entrée dans le flux sanguin, sans effet sur l'activité biologique du médicament.
Le phénol est utilisé comme agent antimicrobien dans une formulation de ProX. L'ITC a été utilisé pour évaluer les paramètres thermodynamiques d'une éventuelle liaison mesurable entre la protéine et le conservateur. La figure 2 porte la chaleur par injection en fonction du rapport molaire de la titration de 60 mM de phénol dans 10 mg/ml de ProX à pH 5,7, 4,5 et 3,5, après soustraction des témoins.
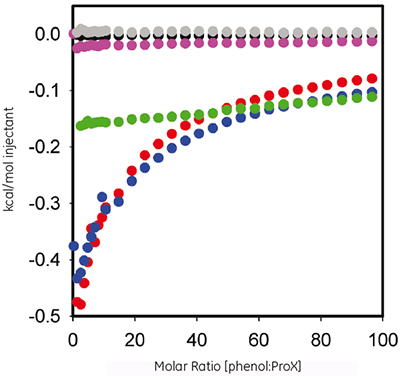
|
Les données d'ITC montrent qu'à pH 5,7 et 4,5, le ProX interagit avec le phénol, mais pas à pH 3,5. Les isothermes résultantes n'ont pas pu être représentées par l'un des modèles de liaison prédéfini, ce qui indique que la liaison est complexe et implique plusieurs sites.
La figure 3 montre les courbes DSC pour 1 mg/ml de ProX dans des tampons de formulation identiques à ceux utilisés pour les expériences d'ITC. Les données de DSC correspondantes montrent que, en l'absence de phénol à pH 5,7, le ProX présentait au moins trois transitions de dépliement avec pour température de dénaturation au point médian Tm1, Tm2, Tm3 respectivement égales à 59 °C, 68 °C et 85 °C, la transition centrale représentant le principal événement de dénaturation. L'enthalpie totale de dénaturation (ΔHdénat) était de 270 kcal/mol. À pH 4,5 la première transition n'était pas décelable. Le principal événement de dépliement a lieu à une Tm2 de 55 °C, et la Tm3 descend à 73 °C. ΔHdénat diminue à 216 kcal/mol, ce qui suggère une diminution de la force des interactions tertiaires. Enfin, à pH 3,5, le ProX était dénaturé par l'acide, comme l'indique l'absence de toute transition détectable dans les données de DSC.
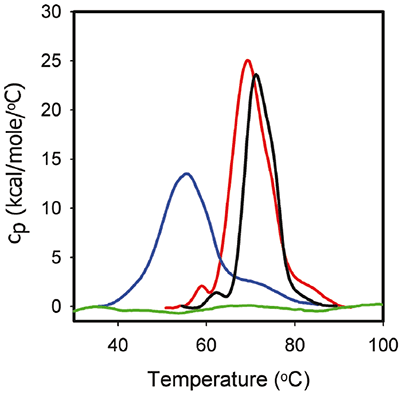
|
La figure 3 présente également le thermogramme DSC de la dénaturation du ProX en présence de phénol à pH 5,7. On remarque que le phénol a augmenté la Tm1 de 1 °C et la Tm2 de 2 °C et a abaissé ΔHdénat à 195 kcal/mol. Toutefois, la structure tertiaire du ProX était identique en la présence et en l'absence de phénol (déterminé à partir de données de caractérisation biophysiques complémentaires telles que la fluorescence, données non représentées). En général, les changements de comportement en DSC peuvent être corrélés à des changements de la structure par d'autres méthodes ; mais cela n'est pas systématique. On suppose que les changements observés par DSC proviennent de la perturbation des forces qui stabilisent la structure native de la protéine (comme les forces de Van der Waals, les interactions hydrophobes et électrostatiques, ainsi que les liaisons hydrogène, etc.) et de l'hydratation des résidus exposés. Une déstabilisation des interactions tertiaires peut réduire la compacité de la protéine, ce qui est détecté par DSC, sans induire les changements structuraux détectables par d'autres méthodes analytiques.
Cette combinaison des données d'ITC et de DSC a révélé des informations importantes sur les interactions entre le phénol et la protéine. Premièrement, le phénol se lie au ProX replié, mais ne se lie pas au ProX déplié (fig 2) ; il est par conséquent important, pour que la structure tertiaire du ProX reste intacte, d'avoir des sites de liaison disponibles pour le phénol. Deuxièmement, comme il est critique que la structure tertiaire de la protéine soit intacte pour qu'elle fonctionne, un pH de 5,7 semble être optimal pour la formulation. Troisièmement, comme on peut le voir sur la figure 2, la liaison du phénol au ProX arrive à saturation pour des rapports molaires supérieurs à 50. Quatrièmement, la DSC (1 mg/ml de ProX dans un tampon de formulation de pH 5,7, contenant 0,005 % (v/v) de phénol) a été réalisée pour un rapport molaire phénol:ProX calculé de 38, qui était proche de, mais pas égal à, la saturation. Cinquièmement, bien que certains sites de liaison n'étaient pas saturés, ce rapport molaire du phénol s'est avéré suffisant pour augmenter la stabilité thermique du ProX.
L'activité antimicrobienne du phénol s'est avérée réduite en présence du ProX (données non représentées). Cette observation, associée a fait que le phénol se lie au ProX, indique que le phénol lié possède une activité antimicrobienne nulle, ou réduite, par comparaison à celle du phénol non lié. Avec l'aide de la courbe de liaison, une concentration en phénol supérieure au point de saturation de liaison pourrait être retenue pour la formulation, la concentration du phénol non lié préserverait une activité antimicrobienne efficace. Les valeurs de Tm supérieures pour le ProX en présence de phénol n'avaient initialement pas été prédites ; toutefois, ceci indique une stabilité thermique améliorée et suggère une meilleure stabilité à long terme de la protéine. Aucune corrélation directe ne peut être établie entre la stabilisation induite par le phénol, et l'efficacité antimicrobienne du phénol.
L'ITC et la DSC ont été utilisés pour identifier et caractériser d'un point de vue thermodynamique les liaisons du phénol au ProX replié à pH 5,7, et du polysorbate-80 au ProX. La constante de liaison mesurée entre le ProX et le polysorbate-80 classe cette interaction comme faible ; ainsi, on peut s'attendre à une dissociation in vivo de la protéine active et des excipients stabilisateurs de la formulation, ainsi qu'à des interférences minimales induites par l'excipient avec les effets biologiques du médicament. Sur la base de la courbe de saturation des titrations ProX-phénol, une concentration en phénol supérieure au point de saturation peut être identifiée afin de créer une formulation ayant une capacité antimicrobienne optimale et une stabilité thermique améliorée. Non seulement la liaison supposée de l'excipient a été confirmée, mais les concentrations adéquates de ces deux excipients (un excès molaire de 10 pour le polysorbate-80 par molécule de ProX aux concentrations supérieures à la cmc, et un excès molaire de 50 pour le phénol par molécule de ProX) ont été identifiées.
Les exigences relatives à la formulation de produits de protéine incluent la sécurité et l'efficacité. L'ajout d'excipients dans le but de créer des substances thérapeutiques à base de protéine efficaces et sûres, ainsi que l'amélioration de la stabilité du produit et sa durée de conservation nécessitent une compréhension des interactions entre la protéine et les excipients au niveau moléculaire. Dans cette note d'application, l'ITC et la DSC ont été utilisées pour caractériser la liaison protéine-excipient, l'une des nombreuses interactions possibles dans une formulation de solution de protéine complexe.
Arakawa, T., et al, Factors affecting short-term and long-term stabilities of proteins. Adv. Drug Deliv. Rev. 46, 307-326 (2001).
Chou, D. K., et al, Effects of Tween 20 and Tween 80 on the stability of Albutropin during agitation. J. Pharm. Sci. 94, 1368-1381 (2005).
Bam, N. B., et al, Tween protects recombinant human growth hormone against agitation-induced damage via hydrophobic interactions J. Pharm. Sci. 87, 1554-1559 (1998).
Ren, X., et al, Pharmaceutical excipients inhibit cytochrome P450 activity in cell free systems and after systemic administration. Eur. Jour. Pharm. Biopharm. 70, 279-288 (2008).
Taheri-Kafrani, A., et al, T. Beta-lactoglobulin structure and retinol binding changes in presence of anionic and neutral detergents. J. Agric. Food Chem. 56, 7528-7534 (2008).