Cette note d'application explore principalement les applications de titration calorimétrique isotherme (ITC) dans la recherche sur les inhibiteurs de kinase, mais aborde également le rôle de la calorimétrie différentielle à balayage (DSC) dans le processus de recherche.
Le kinome d'un organisme est l'ensemble des kinases de son génome, et ces enzymes de modification des protéines sont des cibles potentielles pour différents domaines thérapeutiques. Des études destinées à caractériser le kinome humain, associées à l'explosion du nombre de structures cristallines de kinase disponibles au cours des dernières années, ont accru l'intérêt pour ces kinases en tant que cibles potentielles d'intervention pharmaceutique.
La plupart des inhibiteurs de kinase développés depuis que l'industrie pharmaceutique s'intéresse aux kinases, à la fin des années 1980, ciblent le site de liaison de l'ATP sur l'enzyme. Toutefois, le développement du médicament nommé Gleevec™, un inhibiteur de tyrosine-kinase induisant un réarrangement structural de la cible BCR-Abl kinase, a ravivé la recherche dans ce domaine. Ceci a conduit à des idées permettant d'aborder l'inhibition des kinases de manière innovante, en particulier à travers la création de liaisons en dehors du site de l'ATP et en cherchant à empêcher l'activation de la kinase.
Les études cinétiques détaillées des enzymes jouent un rôle central dans la caractérisation du mécanisme d'action des composés dérivant de ces nouvelles idées. Une technique particulièrement riche d'enseignement est la titration calorimétrique isotherme (ITC), qui fournit un profil thermodynamique complet de la liaison d'un composé avec la protéine cible. Les données produites permettent une comparaison des mesures d'affinité des composés se liant à différentes formes d'une enzyme, comme l'enzyme libre, le complexe enzyme-substrat, le complexe enzyme-produit, l'enzyme active et non-active.
L'inhibition des cascades de signalisation des kinases est une approche thérapeutique établie pour le traitement des maladies dans le domaine de l'oncologie et de l'inflammation. Cette note d'application s'intéresse à l'application de l'ITC pour l'identification du complexe intermoléculaire des kinases qui confère une activité biologique, sachant que l'ITC peut fournir des informations sur l'éventuelle influence de la présence d'un autre ligand sur cette activité.
La titration calorimétrique isotherme mesure différentes caractéristiques d'une interaction, dont l'affinité (KD), le nombre de sites du ligand (n), et l'enthalpie de la réaction (∆H), en une seule expérience. Cette technique est rapide, ne nécessite aucun marquage fluorescent et peut être utilisée avec des protéines ne possédant aucune activité catalytique (dont l'étude ne pourrait passer par des dosages de cinétique enzymatique).
Les expériences d'ITC impliquent généralement une titration du composé test en fonction de la protéine cible à température constante, l'instrument mesurant la chaleur libérée ou absorbée lors de la liaison. Cette technique peut être utilisée de différentes manières pour la recherche de médicament centrée sur une protéine-kinase.
Il s'agit en particulier :
de la caractérisation des hybrides et des préparations de protéine, non seulement en termes d'affinité acceptable vis-à-vis de ligands modèles, mais également pour connaître la stœchiométrie correcte, qui permet une estimation de la quantité de protéine fonctionnelle, sans qu'il soit nécessaire d'avoir une activité catalytique
de l'évaluation des dosages
de l'identification du complexe intermoléculaire conférant l'activité biologique ; l'ITC étant capable de fournir des informations sur l'influence de la présence d'un autre ligand sur l'activité biologique d'un composé test, ce qui est l'objet principal de la présente note d'application.
Avant d'entreprendre des études mécanistiques, il est utile, voire essentiel, de se pencher sur le contrôle de la qualité de la protéine cible. Ceci se traduit par une vérification de l'identité, de la pureté, de la concentration, de la fonctionnalité et de la stabilité de la protéine.
Des méthodes calorimétriques peuvent être appliquées à deux de ces domaines importants. L'ITC a été utilisée pour valider la fonctionnalité de protéines cibles en comparant l'affinité et la stœchiométrie obtenues par titration d'un ligand connu avec des valeurs disponibles dans la littérature pour une palette de protéines cibles. La technologie apparentée de calorimétrie différentielle à balayage (DSC) a été utilisée pour vérifier que la température de dénaturation, Tm, de la protéine est significativement supérieure à la température de l'expérience. Les domaines de kinase isolés ne sont souvent que partiellement stables,avec des valeurs de Tm d'environ 40 °C (figure 1). L'utilisation de cette technique à la caractérisation d'une protéine cible avant de s'attaquer à des études mécanistiques détaillées peut s'avérer économique et peut épargner du temps sur le long terme, en permettant de s'affranchir d'artefacts ou de résultats trompeurs associés à une mauvaise qualité de la protéine. Des températures de fusion basses de domaines de kinase indiquent potentiellement une faible stabilité et mettent en exergue la nécessité d'améliorer les protocoles de purification, le stockage ou les conditions de dosage.
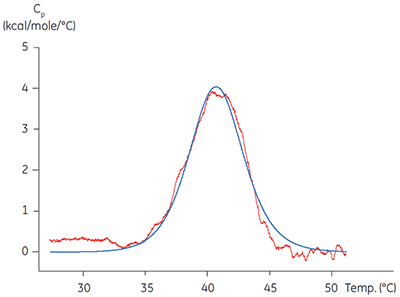
|
Les informations relatives à la présence d'un autre ligand influençant l'activité biologique d'un composé test sont cruciales pour la recherche d'un médicament. Un second ligand peut : n'avoir aucun effet sur l'activité du composé test ; entrer en compétition, directement ou indirectement avec la liaison du composé ; ou être nécessaire pour que le composé test puisse exercer son effet.
La compréhension du mécanisme d'action du composé test peut être utile pour l'interprétation ou la prédiction de l'activité cellulaire à des concentrations en substrat différentes de celles utilisées pour mesurer les valeurs d'IC50. Elle peut également permettre de comprendre la pertinence des structures 3D, qui peuvent être résolues pour différents complexes intermoléculaires. Les informations sur le mécanisme d'action peuvent également être utilisées pour mettre en place les dosages qui en découlent, qui peuvent cibler un complexe intermoléculaire particulier. Les inhibiteurs de kinase peuvent se lier préférentiellement, ou induire des conformations inactives, de la protéine kinase. La comparaison de l'affinité de liaison d'un composé test pour chacune de ces formes est également riche d'enseignement et permet de décider de poursuivre le développement de composés se liant à la forme active ou non active de la protéine. Des décisions de ce type affecteront les processus subséquents impliqués dans la recherche du médicament kinase.
Comme pour toutes les enzymes ayant une importance thérapeutique, les kinases ne sont pas simplement une cible moléculaire sur laquelle intervient un composé. Durant le cycle catalytique, la kinase se lie à un substrat de protéine, à l'ATP, à des intermédiaires et à des produits, (figure 2). Ces différentes formes de l'enzyme peuvent également exister sous différentes conformations. Ainsi il existe différentes formes de l'enzyme vers laquelle des composés peuvent être dirigés et auxquelles peuvent être associés des dosages. La concentration physiologique de l'ATP est d'environ 2 mM, ce qui signifie que l'ATP peut entrer en compétition, souvent très efficacement, avec les composés se liant au niveau du site de l'ATP. Par conséquent, les composés qui se lient avant ou après l'ATP (appelés composés non compétitifs) ou ceux qui se lient uniquement après l'ATP (appelés composés anti-compétitifs) constituent deux approches attrayantes pour la recherche de médicaments de type kinase. En fait, nombre d'inhibiteurs de kinase historiques ciblent le site de l'ATP de l'enzyme et sont censés entrer en compétition avec l'ATP pour la liaison avec l'enzyme. D'autres composés peuvent cibler des sites allostériques, qui n'entrent a priori pas en compétition avec l'ATP. La caractérisation du mécanisme d'action des composés permet d'identifier si la présence de l'ATP, ou d'une protéine substrat, augmente, diminue ou n'a aucun effet sur l'affinité du composé test. Des études de cette nature améliorent grandement la compréhension des relations structure-activité (SAR) au niveau moléculaire et sont la clé de la recherche de nouveaux pharmacophores.
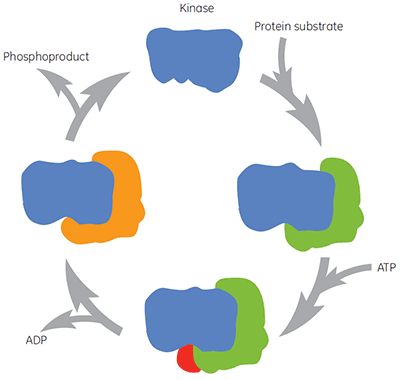
|
Les dosages de cinétique enzymatique ne sont généralement pas conçus pour s'intéresser à certaines formes enzymatiques particulières apparaissant le long du chemin réactionnel. Il est donc parfois difficile d'obtenir directement des informations sur la forme enzymatique concernée et d'en connaître l'affinité maximale. L'ITC permet de contourner cette limitation en mesurant les affinités de liaison à différentes formes enzymatiques prédéterminées. La liaison à l'enzyme libre est l'approche la plus simple, mais les conditions de l'ITC peuvent être choisies pour sonder d'autres formes enzymatiques, comme le substrat enzyme-protéine, les complexes enzyme-ATP, enzyme-ADP, ou enzyme-produit phosphorylé, en fonction du mécanisme catalytique. L'utilisation d'analogues non hydrolysables de l'ATP permet également parfois de sonder des composés potentiels se liant au complexe ternaire que forme l'enzyme avec les deux substrats.
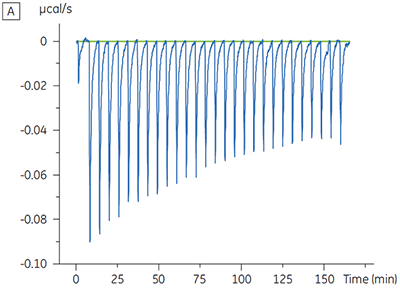
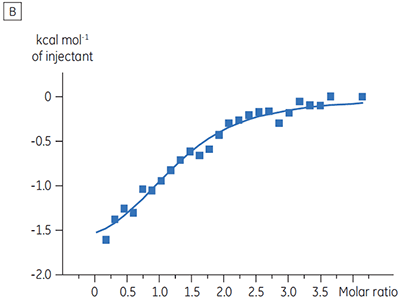
Des expériences destinées à caractériser l'effet de l'ATP sur la liaison d'un composé test ont été réalisées pour une cible protéine kinase. Les titrations ITC ont été réalisées avec le MicroCal™ VP-ITC de Malvern pour un composé test en présence et en l'absence de 100 µM d'ATP, ce qui représente approximativement 60 × KD pour l'ATP (figure 3).
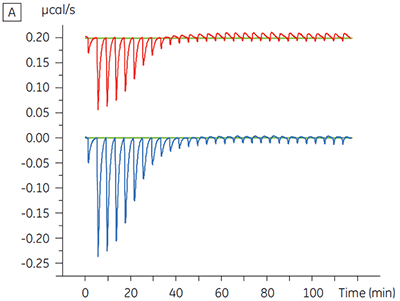
|
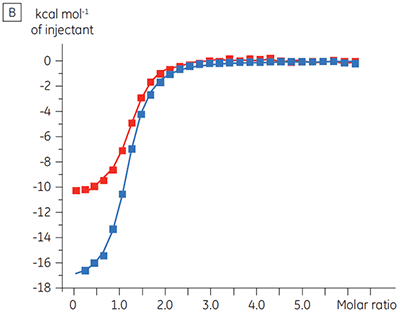
|
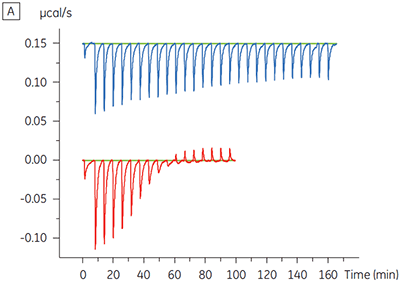
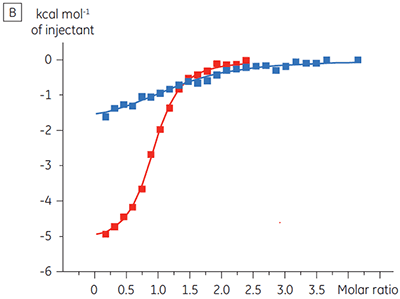
Les résultats d'ITC montrent clairement qu'il n'y a aucun changement de l'affinité pour le composé se liant à la kinase quand l'ATP est associé à la protéine dans la cellule. Les valeurs d'enthalpie indiquent que bien qu'il n'y ait aucun effet sur l'affinité, il y a un effet significatif sur l'enthalpie de liaison. Ces résultats suggèrent par conséquent que le composé est non-compétitif par rapport à la liaison de l'ATP, et qu'il pourrait y avoir un certain degré de changement dans le mode de liaison en présence d'ATP. Ceci montre que l'ITC est utile pour la caractérisation du mécanisme des interactions, en effet l'un de ses grands intérêts est qu'il mesure la constante d'affinité mais aussi l'enthalpie de l'interaction. Une expérience similaire a permis de mettre en évidence des cinétiques anti-compétitives par rapport à l'ATP, pour un autre composé test se liant à la même protéine kinase. KD en l'absence d'ATP était > 50 µM (non mesurable par la méthode ITC standard) alors qu'en présence d'ATP elle a été mesurée à 0,7 µM (figure 4).
|
|
L'avantage de pouvoir suivre directement la liaison à chaque complexe de la protéine a également été montré dans un autre exemple, pour lequel on suspectait une constante de dissociation élevée d'un composé pour un complexe de deux kinases consécutives sur une voie de signalisation. Après avoir montré la formation effective de ce complexe, L'ITC a permis d'étudier l'interaction du composé avec la kinase amont seule ainsi qu'avec un complexe des kinases amont et aval. Une augmentation d'un facteur cinq de l'affinité a été démontrée pour le composé se liant au complexe (figure 5).
|
|
Les méthodes calorimétriques ont montré leur avantage pour l'étude de l'inhibition d'une protéine kinase. Elles ont facilité le contrôle de la qualité des protéines cibles et ont contribué à décortiquer et à comprendre les mécanismes d'interaction.
L'avènement des instruments automatiques et à haut débit, tels que les systèmes MicroCal Auto-iTC200 et le MicroCal VP-Capillary DSC de Malvern, permet d'exploiter au mieux ces applications. Une volonté continue de réduire la consommation de réactifs assure une intégration à long terme des méthodes calorimétriques dans le processus de conception rationnel des médicaments.
Geoff Holdgate, Responsable de recherche, Global Compound Sciences, Lead Generation- Discovery Capabilities & Sciences, Astra Zeneca Pharmaceuticals, Mereside, Alderley Park, Macclesfield, SK10 4TG, UK