Des données de DSC ont été utilisées pour identifier les conditions d'élution apportant la meilleure stabilisation pour l'étape de capture d'anticorps lors du développement d'un procédé pour une protéine, et les conséquences en termes de réduction des coûts de production.
Le développement d'un procédé biopharmaceutique peut être coûteux et nécessiter beaucoup de temps. L'objectif ultime est de maximiser le rendement du produit purifié, par le moyen le plus économique, reproductible et robuste. Comme la perte d'un lot peut avoir des conséquences économiques majeures, une compréhension complète de la stabilité de la protéine sur toute la voie de développement, depuis la recherche, jusqu'au développement clinique et à la fabrication commerciale, est fondamentale pour la commercialisation d'un médicament biopharmaceutique.
La préservation de la stabilité et de la structure active d'une protéine biopharmaceutique jusqu'à son administration est essentielle. Ceci peut être obtenu, en partie, par l'intermédiaire d'études de stabilité destinées à comprendre le comportement physique des substances biothérapeutiques. Du fait de leur complexité et de leur structure fragile, les protéines ont des problèmes inhérents de stabilité. Des études de stabilité pour déterminer l'effet des différents facteurs environnementaux, tels que le pH, la température, et la force ionique, sur l'intégrité conformationnelle d'une protéine, qui influence directement son activité biologique, sont indispensables durant le développement d'un procédé. Ces études de stress aident à identifier les caractéristiques critiques en révélant les points faibles de la molécule et elles fournissent une approche rationnelle en identifiant les mécanismes de dénaturation et en développant des contre-mesures efficaces, à travers la sélection du tampon, du pH, de la force ionique et des excipients appropriés.
|
La conduite d'études de stabilité en parallèle du développement d'une méthode de purification permet aux chercheurs de concevoir des méthodes plus efficaces. Durant le développement d'un processus de purification, les études de stabilité peuvent :
Les études de stabilité facilitent également le développement de dosages robustes et indicatifs de la stabilité. Ces données permettent un développement accéléré des formulations destinées au produit médicamenteux, en minimisant l'étendue des conditions à explorer lors d'études de développement de formulation typiques. Ceci, en retour, se traduit en économies de ressources, d'argent et de temps.
Cette note d'application se focalise sur l'utilité de la calorimétrie différentielle à balayage (DSC) pour guider le développement des procédés de purification des anticorps. En particulier, cette note décrit comment des données de DSC ont été utilisées pour identifier les conditions d'élution optimales lors du développement d'une étape de capture sur protéine A, avec des économies dès la fabrication à l'échelle clinique.
La DSC fournit un moyen de suivre la stabilité des protéines durant le traitement et la manipulation. Celle-ci peut permettre d'améliorer le traitement atypique lors du développement du test.
Toutes les protéines ont été préparées dans le tampon indiqué par dialyse ou échange de tampon avec une colonne de dessalage PD-10 (GE Healthcare). La concentration finale de la protéine était d'environ 1 mg/ml. Les protéines ont été analysées à l'aide d'un système MicroCal VP-DSC de Malvern, en utilisant une plage de température de 5 à 90 °C, avec une rampe de température de 1 °C par minute. L'analyse des thermogrammes a été réalisée avec le logiciel Origin™ en utilisant un modèle soit à deux états soit autre (non-two-state).
La chromatographie d'affinité sur protéine A est couramment utilisée comme étape initiale de capture pour la purification des anticorps monoclonaux. La protéine A se lie à la région Fc de plusieurs molécules anticorps immunoglobuline (Ig). La spécificité et la sélectivité de cette liaison peuvent conduire en une étape à un produit quasiment pur. Les molécules d'anticorps sont produites par culture cellulaire et doivent être séparées des protéines et des acides nucléiques de la cellule hôte, ainsi que des composants du milieu de culture. Un milieu de culture cellulaire conditionné est utilisé pour la chromatographie d'affinité sur protéine A. Les anticorps se lient à la protéine A immobilisée à pH neutre (autour de pH 7) et sont élués avec un tampon acide (par exemple, un tampon citrate de pH 3,5). Les anticorps élués sont neutralisés avec une solution possédant une capacité tampon élevée
comme du Tris 1 M à pH 9, ou par dessalage.
Un problème associé à l'utilisation de la chromatographie d'affinité sur protéine A est que les anticorps, de même que d'autres protéines, peuvent être instables au pH bas nécessaire à l'élution. Si la protéine est instable à pH bas, elle peut précipiter durant ou après l'élution.
La précipitation dépend généralement de la concentration de la protéine : une concentration élevée favorise l'agrégation et la précipitation. Ainsi, bien que la plupart des milieux de chromatographie soient capables de lier au moins 20 g d'anticorps par litre de milieu, la stabilité de la protéine à pH bas, après élution, s'avère être le facteur limitant le chargement du milieu. Bien que de nombreux anticorps soient sensibles au pH, le mécanisme de la dénaturation
et de l'agrégation varie en fonction de la structure et nécessitera des tampons différents pour une stabilité optimale.
Pour améliorer la capacité de chargement et la rentabilité du processus de chromatographie sur protéine A, la protéine doit être stabilisée dans le tampon d'élution. La DSC peut être utilisée pour caractériser la stabilité de l'anticorps en fonction du pH, et déterminer quels additifs permettent d'améliorer la stabilité de la protéine à pH bas. En DSC, une augmentation de la température de transition (Tm) suggère une augmentation de la stabilité de la protéine. La rentabilité de l'étape de chromatographie sur protéine A peut être améliorée en stabilisant l'anticorps dans le tampon d'élution de pH bas, ce qui augmente la capacité de charge.
Dans une étude de cas, un client souhaitait améliorer le procédé de purification de son anticorps (anticorps X). Les informations sur le procédé indiquaient que la capacité de charge initiale était limitée à 2 g d'anticorps X par litre de milieu de protéine A, à cause de la précipitation de l'anticorps qui survenait lors de l'élution à des charges plus élevées. Pour comprendre l'effet du pH sur la stabilité de l'anticorps X, la protéine a été préparée dans quatre tampons différents : un tampon citrate ajusté à pH 7,0 avec du Tris ; un tampon phosphate de pH 7,3 ; un tampon citrate de pH 3,5 ; et un tampon citrate de pH 5,0. D'après les données de DSC (tableau 1) l'anticorps X à pH 7,0 et 7,3 montrait une Tm supérieure par rapport à celle de l'anticorps à pH 3,5, indiquant que la protéine était plus stable aux pH supérieurs. Les températures de début de dénaturation étaient également supérieures à pH 7,0 et 7,3 par rapport à la valeur à pH 3,5. L'anticorps X à pH 5,0 avait une Tm comparable à celle à pH 7,0, et la température de début de dénaturation était inférieure, ce qui suggère que le pH joue un rôle majeur dans la détermination de la dénaturation de cet anticorps.
| Tm de la transition principale | Début de la dénaturation (°C) | |
|---|---|---|
| Tampon Citrate-Tris, pH 7,0 | 68,7 | 60,1 |
| PBS, pH 7,3 | 69,5 | 58,5 |
| Citrate, pH 5,0 | 71,5 | 48,2 |
| Citrate, pH 3,5 | 59,3 | 34,1 |
| Citrate + mannitol, pH 3,5 | 64,7 | 41,0 |
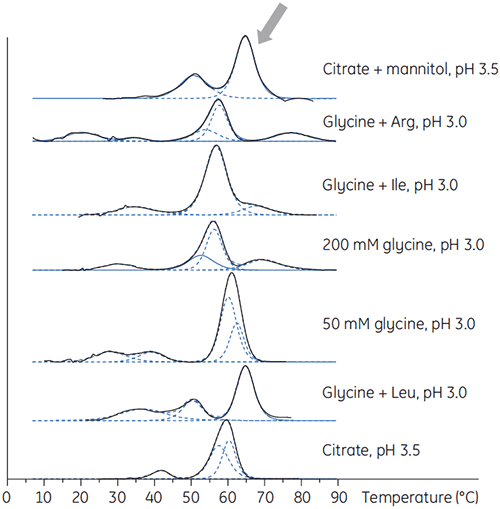
L'anticorps X a également été préparé dans des tampons de pH bas avec différents additifs pour déterminer si l'un de ces additifs serait susceptible de stabiliser l'anticorps aux pH bas. Des expériences de DSC ont été réalisées pour voir quelles conditions augmenteraient la Tm de l'anticorps (figure 2).
|
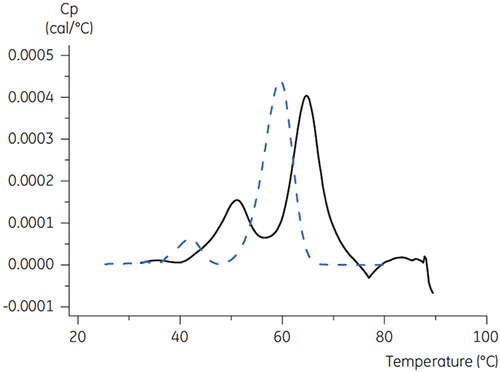
Pour l'anticorps X, le tampon citrate plus mannitol de pH 3,5 a donné le décalage de Tm le plus important, indiquant la stabilité la plus favorable. L'addition de mannitol a augmenté à la fois la Tm et la température de début de dénaturation, par rapport au tampon citrate de pH 3,5 (figure 3).
|
Les résultats de DSC suggèrent que l'addition de mannitol dans le tampon d'élution pour le milieu d'affinité sur protéine A devrait améliorer la stabilité de l'anticorps X. Une stabilité améliorée de l'anticorps durant l'élution permet d'augmenter la charge de l'anticorps dans le milieu de chromatographie sur protéine A.
Les travaux de développement du procédé utilisant les informations de stabilité de la protéine déterminées par DSC ont effectivement conduit à une augmentation de la charge de l'anticorps X lors de l'étape de capture sur protéine A. L'utilisation de citrate additionné de mannitol comme tampon d'élution de la protéine A a conduit à une augmentation d'au moins 7,5 fois de la capacité : ≥ 15 g d'anticorps X par litre de milieu de protéine A, à comparer aux 2 g par litre avec le tampon citrate seul.
L'anticorps X, après l'étape de capture sur protéine A, était également plus concentré que ce qu'il était avec le procédé antérieur, ce qui a permis de supprimer une étape d'ultrafiltration/diafiltration, et a généré des économies en matière et en temps de traitement.
Dans cette note d'application, des données de DSC ont été utilisées pour identifier les conditions d'élution apportant la meilleure stabilisation pour l'étape de capture de l'anticorps d'un procédé de développement d'une protéine. La DSC fournit des informations essentielles pour le choix des conditions tampon permettant de stabiliser la protéine avant le développement d'une méthode chromatographique. La capacité à améliorer les performances de cette étape critique pour le développement des procédés de purification, peut permettre de réaliser des économies substantielles en aval.
Cette note d'application est signée de Prathima Acharya, qui a travaillé pour Diosynth Biotechnology. Nous remercions également Rochelle Bazemore, Sorina Morar, Sue Cook et Jessica Weaver du groupe de développement de purification pour leur contribution à ce travail.