Cette note d'application décrit comment a été utilisé le MicroCal iTC200 de Malvern, qui offre une faible consommation d'échantillon et un débit élevé nécessaires pour assurer la productivité, dans un processus allant du développement des tests à l'optimisation des leads.
L'objectif de toute recherche pharmaceutique est de moduler l'activité d'une cible de sorte à susciter une réponse thérapeutique bénéfique. Un médicament n'est normalement actif que lorsqu'il est lié à sa ou ses cibles physiologiques et qu'il en module l'activité. Par conséquent l'essentiel des phases précoces de la recherche de médicaments est focalisé sur l'optimisation de l'affinité et de la sélectivité envers sa cible, d'un médicament candidat.
La titration calorimétrique isotherme (ITC) est largement utilisée pour la mesure des paramètres thermodynamiques de liaison pour les interactions entre des petites molécules et des protéines. La mesure simultanée de l'affinité de liaison (KD), de la stœchiométrie (n), de l'énergie libre (ΔG), de l'enthalpie (ΔH) et de l'entropie (ΔS) fournit des informations importantes pour différentes étapes du processus de développement d'un médicament.
Les exemples suivants illustrent comment les informations détaillées sur l'interaction, fournies par le système MicroCal iTC200, contribuent aux différentes étapes de la recherche d'un médicament.
Une étude implique l'évaluation d'un peptide se liant à une protéine cible durant le développement d'une méthode de dosage. L'objectif ici est d'améliorer la compréhension des mécanismes d'interaction d'une protéine cible et d'une future, potentielle, substance médicamenteuse. De plus, les données qui en résultent, en particulier la stœchiométrie (n) et l'affinité (KD), peuvent être utilisées pour évaluer la qualité et l'activité de préparations de protéines cibles subséquentes.
Une deuxième application utilise l'ITC comme une méthode complémentaire pour étudier les hits se liant à une protéine cible, après un criblage primaire. Un résultat positif obtenu par ITC, combiné à des données de dosage biochimique et à des données provenant d'autres techniques biophysiques (comme la résonance plasmonique de surface (SPR) et la résonance magnétique nucléaire (RMN)), permet de distinguer avec précision les véritables hits des faux positifs.
La dernière étude s'intéresse aux contributions enthalpique et entropique de l'énergie libre pour des composés en phase d'optimisation des leads. La mesure simultanée de l'affinité de liaison (KD), de la stœchiométrie (n), de l'énergie libre (ΔG), de l'enthalpie (ΔH) et de l'entropie (ΔS) fournit des informations importantes qui soutiennent le développement de leads. Les contributions enthalpique et de entropique à l'énergie de liaison fournissent des indices sur la façon dont le médicament potentiel interagit avec la cible. Ces informations peuvent être utilisées pour comprendre des relations structure-activité et pour soutenir la conception de médicament assistée par ordinateur.
Bien que l'ITC fournisse ces informations importantes et détaillées en une unique expérience, cette technologie n'a pas toujours été très utilisée pour la recherche de médicaments, à cause de la consommation non négligeable de protéine et de composés associée aux méthodologies classiques. L'arrivée du MicroCal iTC200 résout ce problème. En comparaison des anciens systèmes ITC, celui-ci permet de réduire la consommation d'échantillon d'un facteur sept et atteint l'équilibre deux à quatre fois plus vite, ce qui se traduit directement par une augmentation de la productivité.
Tous les peptides, toutes les protéines et les petites molécules ont été produits en interne chez Hoffmann La-Roche. L'instrument MicroCal iTC200 est disponible auprès de Malvern Instruments. Toutes les expériences ont été réalisées à 25 °C.
Tous les tampons ont été dégazés avant utilisation. La cellule d'échantillon a été remplie de Bcl-2 (solution 30 µM) dans 50 mM de HEPES, pH 7,4, 100 mM de NaCl, 0,5 mM de TCEP, et 5 % de DMSO. Les peptides ont été dilués à une concentration de 250 µM dans le même tampon. Chaque volume d'injection était de 3 µl, le temps d'injection de 6 s, avec un délai de 150 s entre les injections. Les données ont été analysées à l'aide du logiciel Origin™ adapté pour MicroCal (OriginLabs).
|
Des données d'ITC, en particulier la stœchiométrie (n) et la constante d'affinité (KD), ont été utilisées pour évaluer la qualité des préparations de protéine.
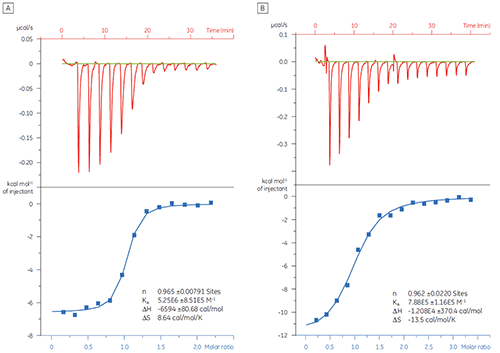
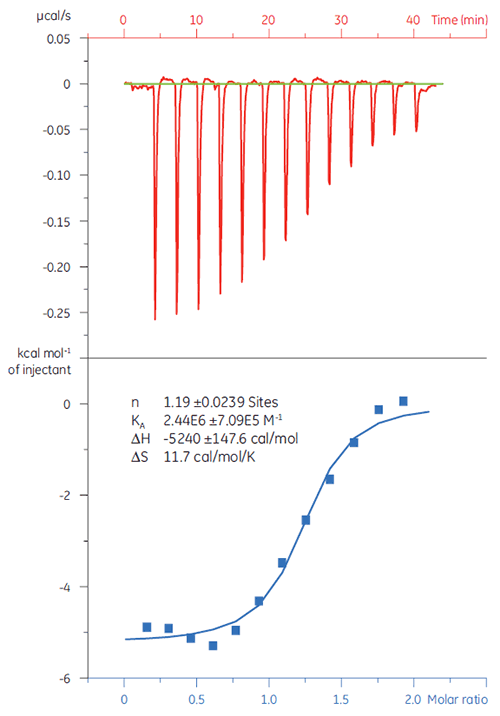
Dans cet exemple, l'interaction de deux peptides différents avec la protéine cible Bcl-2 (nom dérivé de B cell lymphoma 2 - lymphome B 2) a été étudiée à l'aide du MicroCal iTC200. Les résultats sont présentés sur la figure 1. L'affinité de liaison du peptide de type BAD (Bcl-2-associated death promoter - gène pro-apoptotique) pour la protéine Bcl-2 est environ six fois plus forte que celle du peptide BAX (protéine Bcl-2-associated X).
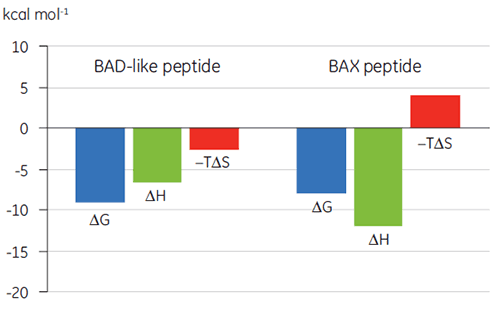
La visualisation des paramètres thermodynamiques sous la forme d'un tracé caractéristique de la liaison (fig 2) facilite la lecture des contributions des composantes enthalpique et entropique à l'affinité globale, représentée ici par ΔG. Ces tracés révèlent que la liaison du peptide de type BAD avec Bcl-2 est constituée d'interactions polaires et d'interactions hydrophobes, comme cela est indiqué par l'enthalpie de liaison (ΔH) négative ou favorable et le facteur d'entropie (TΔS). La liaison du BAX implique plus de changements de conformation, comme cela est indiqué par l'entropie défavorable.
|
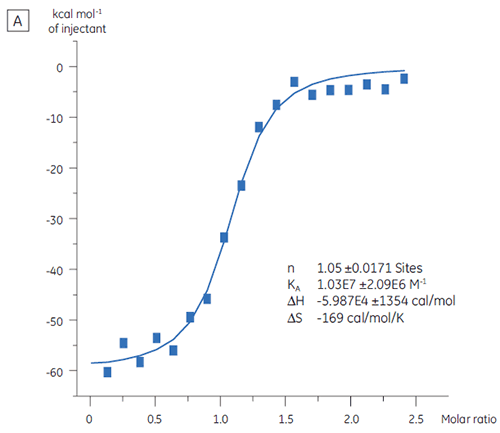
L'ITC peut être utilisée pour évaluer le niveau d'activité de liaison de la protéine cible avant son utilisation dans une campagne de criblage. Dans cette étude, deux lots de protéine cible ont été comparés par titration avec un peptide témoin positif qui se lie à la protéine cible avec une affinité de 97 nM (fig 3).
|
|
Le résultat pour le premier lot, Lot A (fig 3 A) montre une isotherme attendue avec une KD de 97 nM et n = 1, ce qui indique une protéine totalement active. Le second lot, Lot B (fig 3 B) a une KD de 135 nM mais n n'est que de 0,23, ce qui indique une protéine seulement partiellement active. L'analyse de ces données, mais avec une concentration en protéine de 2,3 µM à la place de 10 µM, donne la même valeur de KD et n = 1. Ceci indique que 75 % des protéines du Lot B étaient inactives. La protéine du Lot B a été rejetée et n'a pas été
utilisée pour la campagne de criblage.
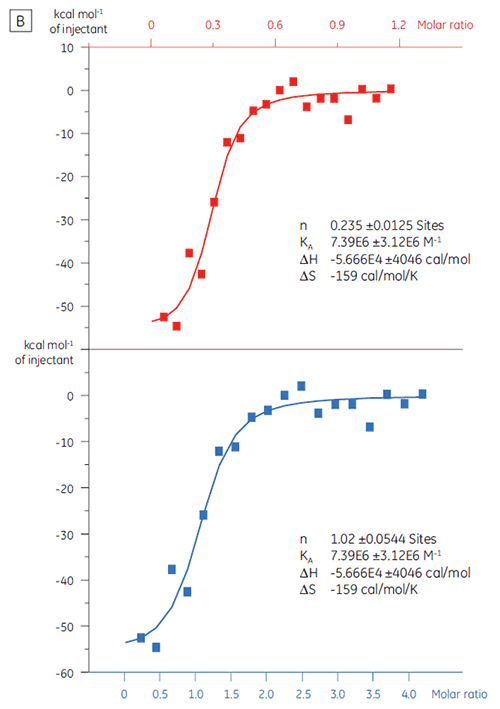
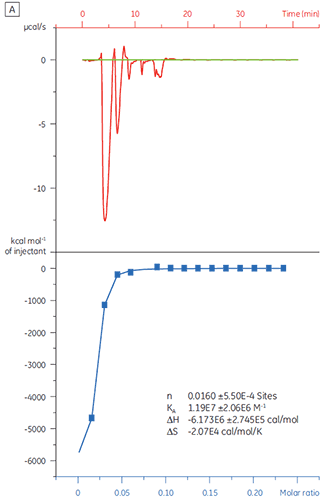
Il est important d'exclure au plus tôt les faux positifs d'une campagne de criblage. Une solution 20 µM de la protéine cible (TP) a été titrée avec un composé X (fig 4). La KD (définie comme 1/KA) a été déterminée comme étant de 4,9 µM, ce qui est en accord avec les études réalisées par SPR et RMN, et confirme donc que le composé X est un véritable hit et mérite d'être étudié plus avant.
|
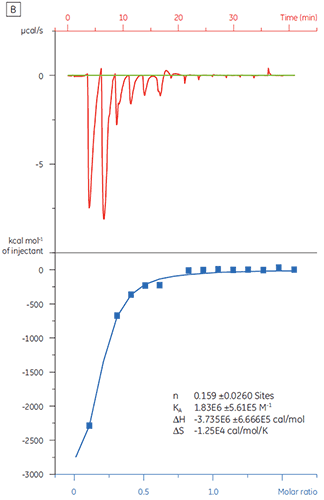
Quand la même protéine cible a été titrée avec un composé Y les résultats ont été très différents (fig 5). Sur le panneau de gauche, le composé Y a été titré avec la TP. L'isotherme montre une affinité de liaison apparente de 120 nM mais l'enthalpie de liaison était environ 1000 fois plus grande qu'attendu et la stœchiométrie était très faible (n = 0,01). Sur le panneau de droite, le même médicament candidat a été titré avec du sérum-albumine bovin (BSA). Pris ensemble, les résultats indiquent une activité non spécifique. Sur la base de ces expériences, le composé Y a été considéré comme un faux positif et a été exclu de l'étude.
|
|
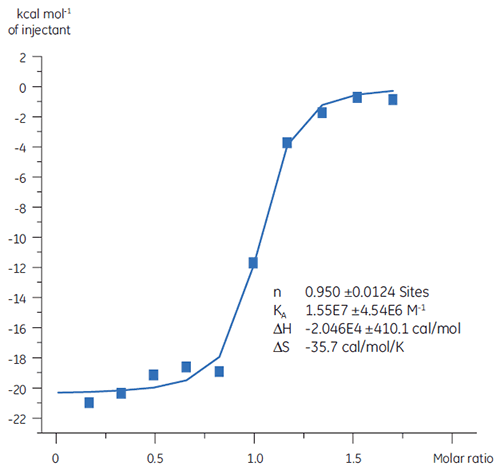
Des études antérieures de la liaison du composé A à la TP ont suggéré une KD de 25 nM. Une expérience d'ITC a été réalisée pour pousser plus loin la caractérisation des paramètres thermodynamiques de cette interaction (fig 6). Une solution à 100 µM du composé A a été titrée dans une solution à 10 µM de TP et la valeur de KD était de 65 nM. La signature de la liaison (fig 7) montre que l'affinité est fortement due aux interactions enthalpiques mais défavorisée par l'entropie.
Les interactions enthalpiques sont généralement dues aux liaisons hydrogène et aux interactions de Van der Waals alors que l'affinité de liaison entropique favorable provient d'interactions hydrophobes. L'entropie défavorable, comme dans cet exemple, provient d'une diminution globale des degrés de liberté des espèces en interaction par rapport au complexe. Ceci est toujours le cas quand deux molécules interagissent mais l'amplitude de l'effet suggère que la protéine a subi un changement de conformation ou que le ligand est très flexible. Une réduction de cette entropie défavorable offre une voie d'optimisation qui peut être suivie par ITC.
Il a déjà été montré qu'il est plus difficile d'optimiser l'enthalpie que l'entropie de liaison, et que le fait de se reposer de façon trop importante sur l'optimisation de l'affinité sur la seule base de ces paramètres peut conduire à un composé ayant de piètres propriétés pharmacocinétiques (trop hydrophile ou trop hydrophobe). Ceci suggère qu'il est préférable de démarrer avec un lead favorisé par l'enthalpie, puis de la modifier pour en améliorer les interactions entropiques.
|
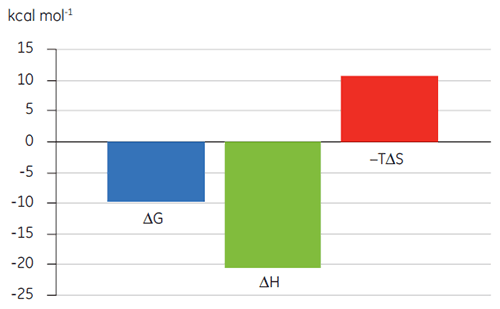
|
Grâce à l'utilisation du MicroCal iTC200, la technique ITC a été intégrée au processus de recherche d'un médicament, et il a été montré que :
Les données ont été aimablement fournies par le Dr. Lin Gao, Hoffman-La Roche, Nutley NJ, USA.