Ce document illustre l'utilisation de cette technique pour l'étude de la stabilité de domaines individuels dans des protéines comportant plusieurs domaines et pour l'orientation du processus de développement d'anticorps et d'autres protéines.
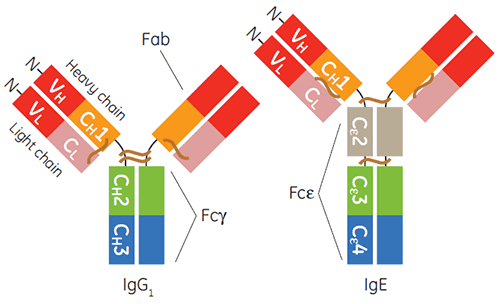
La production et la purification des immunoglobulines d'isotype gamma, en particulier l'IgG1 humaine, pour le diagnostic ou à des fins thérapeutiques, sont des opérations réalisées pour ainsi dire en routine. Durant la dernière décennie, les substances thérapeutiques à base d'IgE ont également pris de l'ampleur (1-3). L'IgE est importante pour la défense de l'hôte contre certains parasites et pour l'inflammation protectrice. Néanmoins, la signalisation faisant intervenir l'IgE par l'intermédiaire de ses récepteurs est également un point d'intérêt pour les maladies allergiques inflammatoires (4). La région constante de l'IgE, est un homodimère contenant des paires dupliquées de trois domaines Ig-repliés uniques (Cε2, Cε3 et Cε4), et est responsable de la liaison de ses deux récepteurs, FcεRI et CD23, également appelé FcεRII (figure 1).
Cette note d'application aborde l'utilité de la calorimétrie différentielle à balayage (DSC) pour obtenir des informations sur plusieurs aspects des processus de développement biothérapeutique d'IgG et d'IgE. La DSC permet d'étudier rapidement la dénaturation de protéines sans avoir à recourir à un marquage ou à des sondes artificielles. Cette technique détermine la chaleur absorbée par l'échantillon lors de la dénaturation de la protéine, et donne une mesure de sa thermostabilité et une indication de sa stabilité à long terme.
En particulier, les travaux décris ici montrent que la DSC apporte des connaissances utiles pour la manipulation, la purification, et la formulation de produits médicamenteux à base d'IgG et d'IgE. L'aptitude du dichroïsme circulaire (CD) à contribuer à ces observations est confrontée aux capacités de la DSC. La DSC permet l'étude de la stabilité des protéines au niveau de chacun des domaines des protéines multidomaines, un aspect qui transparaît moins à travers les données de dichroïsme circulaire.
|
Les expériences ont été réalisées avec le MicroCal VP-Capillary DSC de Malvern.
Les protéines Fcε, Fcγ et Fcγ-Cε2 purifiées ont été obtenues comme précédemment décrit (5). L'ensemble des expériences de DSC capillaire, plus de 400 analyses à différentes valeurs de pH, a été réalisé sur une période de quatre mois sans effort particulier. La préparation des expériences à nécessité environ trois heures pour les Fcε et Fcγ, y compris la mesure des concentrations des protéines, les dilutions, et la préparation de la plaque. Le reste de l'expérience a été réalisé par le sytème automatisé du MicroCal VP-Capillary DSC. Le détail est donné dans la référence (5).
Une stabilité sur une large plage de pH et de salinité est une condition indispensable pour de nombreux procédés de purification des protéines par affinité réalisés dans un contexte industriel. Une mauvaise tolérance à des conditions de pH ou de salinité inhabituelles peut conduire à une agrégation ou une perte de la fonctionnalité de la protéine. La tolérance du Fcε à différentes conditions de pH/salinité est une information importante pour la détermination d'un schéma de purification approprié et extrapolable, pour des protéines contenant des IgE/Fcε. Pour étudier l'effet du pH sur la structure secondaire du Fcε, des spectres de dichroïsme circulaire (CD) ont été enregistrés pour la protéine dans des conditions tampon allant de pH 4,5 à 7,4.
Entre pH 5,2 et 7,4, les spectres du Fcε étaient identiques et présentaient un unique minimum entre 216 et 217 nm, indicatif de la présence significative de feuillet ß et caractéristique de domaines d'Ig. À pH 5, le spectre du Fcε se décale vers celui de la pelote aléatoire (le minimum se décale vers 200 nm), et à pH 4,5, le spectre suggère que la protéine est majoritairement sous forme de pelote aléatoire (5). Sur la base de la dépendance de la dénaturation au pH, nous avons étudié si la stabilité du Fcε peut être atténuée entre pH 7,0 et 4,5.
Une dénaturation thermique du Fcε à différentes valeurs de pH a été enregistrée en DC dans l'UV lointain. À pH 7,0, une transition est visible pour la dénaturation des trois domaines (Cε2-4). Une transition similaire a été observée à pH 6,0, bien que la Tm apparente ait diminué de 1 °C. La dénaturation thermique du Fcε à pH 5,2 a conduit à une transition beaucoup plus large qui commence 6 °C plus bas que pour un pH neutre. Ce n'est qu'à pH 4,8 qu'apparaissent clairement deux transitions (5).
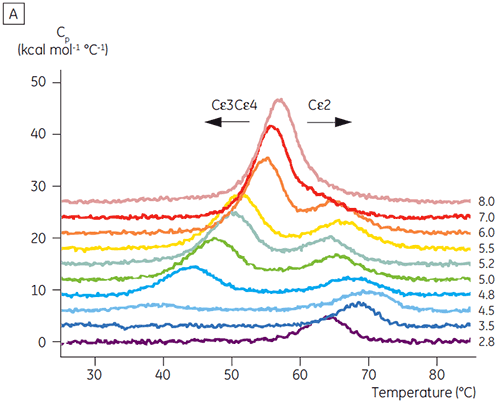
Sur la base des résultats de CD initiaux, des études détaillées de stabilité en fonction du pH ont été initiées pour Fcε et Fcγ, en utilisant la DSC. Les transitions de dénaturation des Fcε et Fcγ se sont avérées irréversibles et fonction de la vitesse de balayage (données non représentées), ce qui suggère qu'une agrégation irréversible affecte les valeurs de Tm apparentes des deux protéines (6, 7). Contrairement à ce qu'a permis de déterminer l'analyse par CD, le Fcε présente deux transitions de dénaturation indépendantes, à toutes les valeurs de pH inférieures à 8,0 (figure 2A). L'une de ces transitions est déstabilisée à pH bas et concentration en NaCl élevée, alors que l'autre ne l'est pas.
|
|
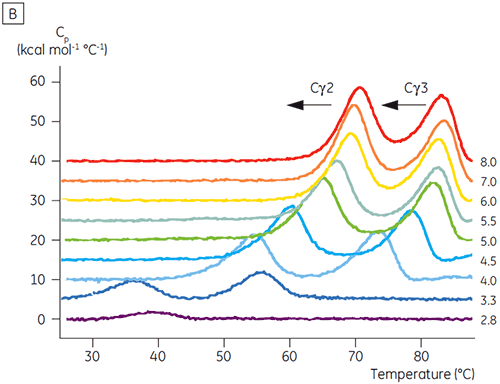
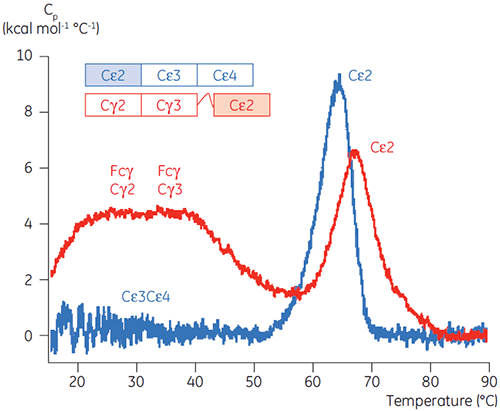
Les domaines impliqués dans la transition sensible au pH étaient totalement dépliés à pH 4,5 comme le suggéraient les données structurales obtenues par CD, ce qui illustre le fait que la DSC peut être importante, non seulement pour la compréhension de la stabilité des domaines repliés, mais également pour connaître l'état du repliement. Le Fcγ (de l'IgG1) s'est avéré se déplier selon deux transitions distinctes ; la transition à basse température appartenant au domaine Cγ2 et la transition à haute température, au domaine Cγ3 (figure 2B). La transition Cγ2 a été identifiée par l'effet qu'a la déglycosylation sur sa thermostabilité (résultats non publiés) et la transition Cγ3 par sa thermostabilité inhabituellement élevée (8). Les deux domaines Fcγ se sont avérés être sensibles au pH et à la concentration de NaCl. Contrairement au Fcε, les domaines Fcγ ne se sont pas intrinsèquement dénaturés avant d'atteindre une valeur de pH inférieure à 3,0, ce qui suggère pourquoi les anticorps sont élués d'un milieu de protéine A à des valeurs de pH inférieures à 3,5, et pourquoi la chromatographie par échange de cation peut être une technique de purification appropriée pour l'IgG (figure 3).
|
|
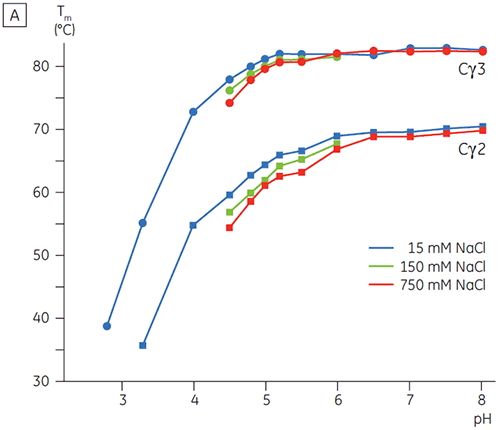
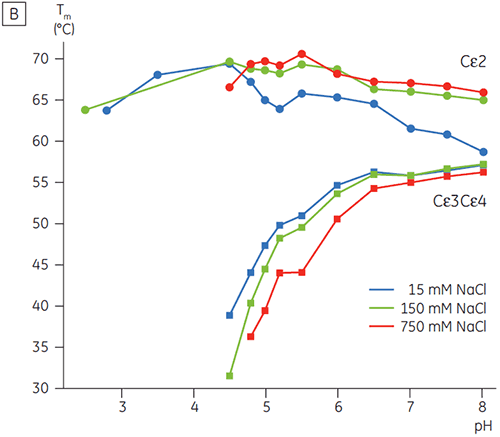
En présence d'une salinité élevée, les domaines Cγ2 et Cγ3 du Fcγ et les domaines Cε3 et Cε4 du Fcε ont été déstabilisés. Ceci se traduit par un petit décalage des valeurs de Tm à 150 et 750 mM de NaCl par rapport aux valeurs à 15 mM de NaCl dans la plage de pH intermédiaire entre 5,0 et 7,0 (figure 3A). Il est peu probable que ces petites différences de stabilité aient un effet important sur la demi-vie in vitro du Fcγ dans cette plage de pH car les Tm des deux domaines Cγ2 et Cγ3 restent supérieures à 60 °C.
Les domaines sensibles au pH du Fcε ont été identifiés comme étant les domaines de liaison du récepteur (Cε3 et Cε4) par des expériences de DSC avec une protéine de fusion Fcγ-Cε2. Un domaine de Fcγ-Ce2 et de Fcε reste replié de façon stable à pH 2,5 (figure 4). Sur la base des expériences décrites plus haut, on sait que les domaines Fcγ sont intrinsèquement dénaturés à un pH inférieur à 3,0. Par défaut, ceci identifie le domaine Cε2 du Fcε comme le domaine insensible au pH. Ces résultats ont été confirmés par protéolyse limitée du Fcε à pH 4,5 (5).
|
À forte concentration en sel, le domaine Cε2 du Fcε s'est avéré légèrement plus thermostable. Le Cε2 était particulièrement stabilité à pH neutre et 750 mM de NaCl, avec une Tm de plus de 7 °C supérieure à la Tm mesurée dans 15 mM de NaCl (figure 3B). Par contraste, le NaCl déstabilise significativement les domaines Cε3Cε4 entre pH 5 et 6 (figure 3B). Le Cε3Cε4 commence à se déplier à pH 5,0 pour une faible concentration en sel. À une forte concentration en sel, la transition de dénaturation est décalée de 0,5 unité de pH à pH 5,5, ce qui exclut l'utilisation de la chromatographie par échange de cations comme un moyen de purification possible de l'IgE ou de protéines contenant le Fcε.
Dans cette étude, nous avons montré que le Fcε présente une sensibilité inhabituelle au pH qui se traduit par la dénaturation de ses domaines de liaison au récepteur à 2 unités de pH plus haut que ce qui avait été observé pour le Fcγ (c.-à-d., pH 5,0). La sensibilité au pH/à la force ionique du Fcε déterminée par DSC a fourni des informations utiles pour le choix des stratégies de purification, des procédures de manipulation et des formulations pour les protéines à base IgE et suggère que des protocoles standards pour l'IgG ne sont pas raisonnables. Les données de stabilité au pH pour le Fcγ suggèrent également un mécanisme similaire pour l'agrégation de l'IgG avec le temps lors de purifications par affinité standard (ex. le plus souvent sur un milieu de protéine A) qui inclut une élution à faible pH et peut-être également des étapes de rétention.
Cette note d'application a aimablement été rédigée par le Dr Stephen Demarest, Biogen Idec, San Diego CA.
1. Zhu, D. et al. A novel human immunoglobulin Fcγ Fcε bifunctional fusion protein inhibits Fcε RI-mediated degranulation. Nature Med. 8, 518–521 (2002).
2. Zhu, D. et al. A chimeric human-cat fusion protein blocks cat-induced allergy. Nature Med. 11, 446-449 (2005).