Dans cette note d'application, nous allons voir comment la gamme d'instruments NanoSight utilise l'analyse de suivi des nanoparticules (Nanoparticle Tracking Analysis - NTA) pour mesurer les dimensions et la concentration des microvésicules et des exosomes (vésicules extra-cellulaires) aux faibles concentrations. Utilisée conjointement avec des marqueurs fluorescents, cette technique permet de déterminer et d'analyser sélectivement des types spécifiques de particule au sein d'un échantillon complexe.
Le principal intérêt concerne les microvésicules et les nanovésicules (exosomes), car celles-ci sont de plus en plus citées comme des biomarqueurs potentiels. Bien que dans ce champ émergeant, les définitions soient encore imparfaitement formalisées, ces deux classes de bionanoparticules se différencient à la fois par leurs plages de taille et leurs biogenèses. De manière générale, les microvésicules sont décrites comme ayant un diamètre de 100 nm à 1 μm, alors que les exosomes se situent dans la plage de diamètre de 30 nm à 100 nm. Les microvésicules sont généralement obtenues par formation d'un bleb à partir de la membrane plasmique, alors que les exosomes sont libérés par exocytose à partir de corps microvésiculaires de l'endosome. Les deux semblent impliquées dans la signalisation cellulaire, et portent différentes protéines de signal ainsi que de l'ARN messager et des molécules de microARN. Les niveaux de circulation s'avèrent élevés lors de différents troubles, dont l'athérosclérose et les maladies touchant les artères coronaires, les maladies hématologiques et inflammatoires, le diabète et le cancer.
À ce jour, la recherche sur les exosomes a été limitée par le manque de méthodes de caractérisation adaptées. La gamme NanoSight de Malvern répond à ce besoin grâce à une technologie unique et éprouvée. L'analyse de suivi des nanoparticules (NTA) permet de visualiser individuellement et en temps réel des exosomes et des microvésicules spécifiques dans la plage de diamètre de 50 à 1000 nm en suspension. La NTA fournit simultanément des profils de distribution de taille de particules à haute résolution et des mesures de concentration. Cette technique simple d'utilisation, rapide, robuste, précise et économique, constitue un complément intéressant aux méthodes existantes. Le fonctionnement en mode fluorescence permet une caractérisation et une différenciation des particules convenablement marquées à l'aide d'une gamme de longueurs d'onde d'excitation.
La diffusion dynamique de la lumière (DLS) et la NTA mesurent toutes deux le mouvement brownien des nanoparticules, dont la vitesse de déplacement, ou le coefficient de diffusion (Dt), sont reliés à la taille de particule à travers l'équation de Stokes-Einstein.
Avec la NTA, une lumière laser éclaire les particules en suspension et une caméra vidéo capture la lumière diffusée. La diffusion des particules est déterminée grâce au suivi des changements de position de chaque particule dans deux dimensions. Connaissant Dt, il est possible de déterminer le diamètre hydrodynamique des particules.
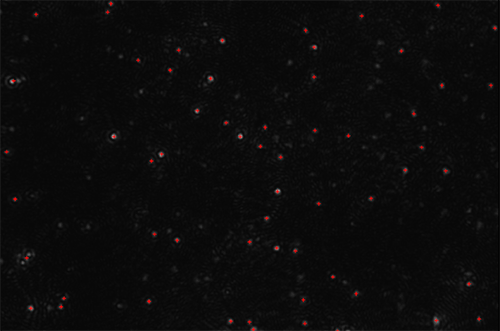
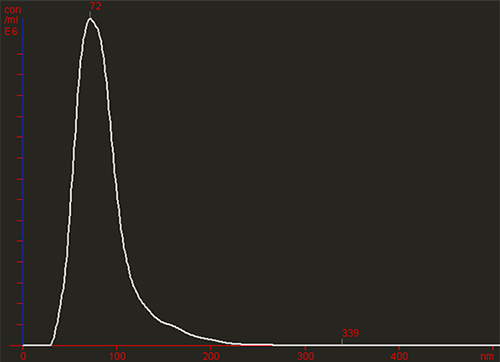
L'image ci-dessous montre des particules soumises au mouvement brownien. L'inspection visuelle initiale révèle la présence de particules plus grosses ou de matière agrégée (Figure 1A). Le logiciel NTA génère ensuite rapidement une distribution de taille à haute résolution en considérant chaque particule et un comptage (soit une concentration absolue basée sur le nombre de particules dans un volume connu) des vésicules observées (Figure 1B).
|
|
Traditionnellement, plusieurs techniques ont été utilisées pour caractériser les micro- et les nanovésicules ; les techniques les plus fréquentes concernant l'analyse de particules de taille micrométrique. Il s'agit de :
Parmi celles-ci, la plus utilisée est la cytométrie en flux. Les dispositifs de cytométrie en flux commerciaux possèdent en général une limite inférieure de taille de particule (pour les sphères de polystyrène) située à environ 300 nm. En deçà, le signal ne peut plus être distingué du bruit de la ligne de base. Bien qu'il soit possible d'étendre cette limite de détection à l'aide de marqueurs fluorescents, aux dimensions les plus basses, la capacité à mesurer avec précision ce type de particules est grandement limitée. La DLS a également été utilisée pour cette application et a fourni des informations de taille précises pour des échantillons monodisperses. La NTA peut fournir des informations complémentaires à la DLS lorsque des distributions de taille à haute résolution sont nécessaires. La microscopie électronique est un outil de recherche utile pour l'étude des micro- et nanoparticules, mais il s'agit d'une technologie très onéreuse à l'usage, nécessitant un travail important de préparation d'échantillon, qui ne permet pas des cadences d'analyse élevées et par laquelle l'intégrité de l'échantillon est perdue après la préparation.
Bien que l'information recherchée soit souvent la présence de particules d'une taille ou d'une plage de tailles données dans un échantillon, il peut également être utile d'identifier et de discriminer des sous-populations spécifiques de particules au sein d'un échantillon. La technique NanoSight est capable d'analyser sélectivement ces populations à travers, par exemple, l'utilisation d'un marquage fluorescent par l'intermédiaire d'un anticorps. Cette approche permet à l'utilisateur de détecter et d'analyser uniquement les nanoparticules spécifiques auxquelles se lie l'anticorps pourvu d'un marqueur fluorescent, l'utilisation de filtres optiques appropriés permettant d'exclure les particules non spécifiques du milieu. Bien qu'il soit possible d'utiliser toute une palette de fluorophores, les résultats les meilleurs sont obtenus avec des quantum dots de haute stabilité et de haute efficacité d'émission.
Cette technique est illustrée avec la figure 2A qui montre une capture vidéo de la lumière fluorescente émise par des quantum dots excités par un instrument NanoSight pourvu d'une diode laser appropriée émettant dans le bleu-violet (405 nm). Ces quantum dots ont été utilisés pour marquer un anticorps (NDOG II) spécifique du biomarqueur cible présent sur une microvésicule syncytiotrophoblaste (STBM).
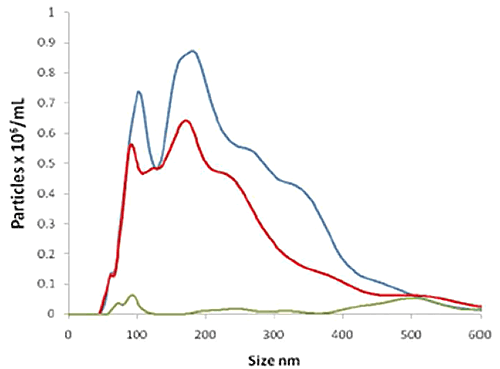
La figure 2B montre trois distributions de taille faisant apparaître : i) toutes les particules présentes dans l'échantillon de STBM (ligne bleue) telles qu'elles sont détectées par diffusion de la lumière (non-fluorescente) ; ii) les particules auxquelles sont spécifiquement liés des anticorps NDOG II portant un marqueur à point quantique fluorescent, mesuré en mode fluorescence (ligne rouge) ; et iii) un témoin (ligne verte) comprenant un anticorps similaire marqué d'un point quantique mais dans lequel l'anticorps n'a aucune affinité pour le biomarqueur cible de la STBM (également mesuré en mode fluorescence). Ceci montre que la majorité des particules présentes dans l'échantillon ont été marquées correctement et spécifiquement par l'anticorps NDOG II portant un quantum dot spécifique de la STBM et que le témoin donne effectivement un signal très faible.

|
|
La NTA permet de mesurer la taille et la concentration de microvésicules et d'exosomes en faible concentration et, utilisée en conjonction avec des marqueurs fluorescents, elle permet de déterminer sélectivement et d'analyser des types spécifiques de particules au sein d'un échantillon complexe.